蝙蝠是「百毒不侵」的天然病毒蓄水池,它們為什麼攜帶大量病毒卻免受其害?人類是否可以從這裡尋求一條對付多種病毒的普適性思路?
北京時間3月31日,清華大學結構生物學高精尖創新中心、杜克-新加坡國立大學醫學院、中國疾控中心、中科院動物研究所、美國杜克大學的研究團隊聯合在論文預印本網站BioRxiv在線發表了一項最新研究,「Orthogonal genome-wide screenings in bat cells identify MTHFD1 as a target of broad antiviral therapy」。該研究尚未經同行評議。

研究團隊通過對蝙蝠細胞的兩萬多個基因進行系統全面的篩查,確定了數十個病毒復制所依賴的關鍵蝙蝠基因,並發現了一個共同的新的宿主基因MTHFD1。
進一步的研究發現蝙蝠細胞的MTHFD1表達水平比人類相應組織的細胞要低很多,這可能和蝙蝠適應飛行生活的生理變化有關。
研究團隊最終發現宿主蛋白MTHFD1的抑制劑carolacton可有效抑制新冠病毒復制。
他們認為,該研究成果不僅能助力新冠病毒藥物研發,有力抗擊疫情,更為人類未來抗擊突發病毒流行打下基礎。
清華大學結構生物學高精尖創新中心譚旭研究員和杜克-新加坡國立大學醫學院王林發教授為論文的共同通訊作者。清華大學藥學院博士生崔進、博士後葉倩、杜克-新加坡國立大學醫學院Danielle Anderson、中國疾控中心黃保英博士為論文的並列第一作者。該研究還得到了中國疾控中心譚文傑研究員、中科院動物所周旭明研究員、美國Duke大學的So Young Kim教授的幫助。
此外,譚旭實驗室的這項工作由清華大學疫情防控科技攻關應急專項課題,北京市結構生物學高精尖創新中心、清華-北大生命科學聯合中心和國家自然基金委優秀青年基金聯合資助。
人類需要廣譜抗病毒藥物
從SARS、埃博拉到2019年的新冠肺炎(COVID-19),病毒引起的傳染性疾病一直是嚴重危害全球健康的主要病種之一。這些疫情發展史更讓我們深刻體會到當務之急是對於廣譜的抗病毒藥物的研發。
廣譜抗病毒藥物對於新發突發病毒感染的應急性治療可以救重症病人於危難,對於降低死亡率和緩解疫情有不可估量的作用。
然而,傳統的抗病毒藥物以病毒蛋白作為靶點,它們在應對不斷出現的多種不同類別的病毒時很難發揮作用,而且病毒也很容易通過突變自身基因而產生耐藥性。
相比之下,由於多種病毒在細胞內復制需要很多共同的宿主蛋白才能完成復制周期,所以針對病毒復制依賴的宿主蛋白的新型抗病毒藥物可能具有廣譜性和不易產生耐藥性的優點。
論文中提到,蝙蝠是埃博拉病毒、SARS-CoV、MERS-CoV、亨尼巴病毒屬和新冠病毒等病毒的天然宿主。研究團隊試圖從蝙蝠基因組分析入手,使用領先的功能基因組學方法,系統地尋找病毒生命周期依賴的宿主因子,通過理解病毒-宿主因子的相互作用的分子機制來尋找新的抗病毒藥物靶點。
蝙蝠為何「百毒不侵」?
蝙蝠屬於哺乳動物門翼手目,是唯一能真正飛行的哺乳動物。近年來諸多大規模致死疫情都和蝙蝠發生著千絲萬縷的聯系,而蝙蝠也已經被公認為新興病毒最重要的天然「蓄水池」。
作者們提到,2003年的SARS、2014年的埃博拉以及2019年末開始暴發的的新冠肺炎均給世界各地帶來了巨大的經濟損失和心理恐慌。諸多證據支持蝙蝠是這些致病病毒的共同的天然宿主,病毒從蝙蝠到某個中間宿主傳播最終導致了疫情的大規模暴發。
然而,令人不解的是,雖然蝙蝠可以攜帶多種致病病毒,但是這些病毒卻不會對蝙蝠造成明顯的症狀。蝙蝠對病毒的高度耐受性可能也是其能攜帶並傳播多種病毒的重要原因。
中科院武漢病毒研究所研究員周鵬曾在接受采訪時表示,「從免疫學角度來說,蝙蝠的免疫系統還是很獨特的,它是唯一一個會持續飛行的哺乳動物,飛行這種能力就造成它很多基因和人或者其他哺乳動物的基因不一樣,這些不一樣的基因很多就是和抗病毒、免疫系統相關的。」
周鵬等人此前也證實,蝙蝠體內總是保持了一定量的干擾素表達。干擾素是一個很關鍵的抗病毒蛋白,如果它在身體中總是保持「低量」,就相當於動物本身具有「全天候保護」的防御機制。
「我們現在初步的結論是它的免疫通路會保持一定量的防御狀態,但不會免疫過激。像人感染SARS等病毒最後會死於過度的炎症反應,但是蝙蝠的炎症反應和先天免疫不會過激,所以它也不會受到損傷。」
周鵬等人此前也提到過類似思路,研究蝙蝠攜帶病毒而不患病這一獨特之處,有望讓人類從中學習如何對抗病毒。
作者們認為,蝙蝠的生理學研究和基因組測序結果為解釋其耐受病毒的能力提供了多種解釋,而功能基因組學篩選可以幫助我們進一步理解病毒感染蝙蝠細胞所需要的宿主因子。
兩萬多個基因篩選:蝙蝠與人類的病毒感染機制有何不同?
基於以上背景,研究團隊建立了第一個蝙蝠(黑妖狐蝠,Pteropus alecto)的全基因組CRISPR敲除文庫並完成了黑妖狐蝠腎上皮細胞(PaKi細胞)的流感病毒感染的全基因組CRISPR篩選,從中找到了20多個病毒復制所依賴的宿主因子(圖一)。
與此同時,杜克-新加坡國立大學醫學院的王林發課題組用RNA干擾(RNAi)的方法進行了蝙蝠細胞針對腮腺炎病毒感染的篩選,找到了數十個病毒依賴的宿主因子。
通過對兩個課題組的篩選結果進行比較,研究團隊發現其中都包括細胞內吞作用和蛋白分泌通路的重要基因,這些跟人類細胞的病毒感染是類似的,說明蝙蝠細胞和人類細胞的病毒感染對這些通路的依賴是保守的。
除此之外,兩組篩選都發現了一個共同的新的宿主基因MTHFD1。MTHFD1編碼亞甲基四氫葉酸脫氫酶,是DNA和RNA的組成成分嘌呤堿基從頭合成的重要代謝酶。
非常有意思的是,以前的工作在人體細胞的全基因組篩選病毒宿主因子都沒有發現MTHFD1。進一步的研究發現蝙蝠細胞的MTHFD1表達水平比人類相應組織的細胞要低很多,這可能和蝙蝠適應飛行生活的生理變化有關。
總體來說,研究團隊通過對蝙蝠細胞的兩萬多個基因進行系統全面的篩查,確定了數十個病毒復制所依賴的關鍵蝙蝠基因。這些基因在蝙蝠和人類中功能是保守的,但是基因表達水平的物種差異可能決定了病毒感染的不同的病理結果。
發現抑制劑carolacton
研究團隊進一步發現,RNA病毒包括腮腺炎病毒、馬六甲病毒、寨卡病毒等都對MTHFD1的缺失非常敏感,而MTHFD1的抑制劑carolacton對於上述病毒的復制有非常強的抑制作用。這個現像在蝙蝠和人類細胞都很顯著。
Carolacton是一種天然產物,被作為抗生素候選分子用於抑制細菌的菌膜生成。
令人欣喜的是,通過與中國疾控中心合作,研究團隊發現carolacton也能有效的抑制新冠病毒在人體細胞中的復制,而且抗病毒有效濃度遠遠低於細胞毒性濃度,展示出了良好的成藥性。
蝙蝠的基因篩查導致了MTHFD1這個全新的抗病毒藥物靶點及carolacton這個抗病毒小分子的發現。這個結果也提示我們可以從研究蝙蝠的病毒感染機制中學習到如何應對病毒感染。
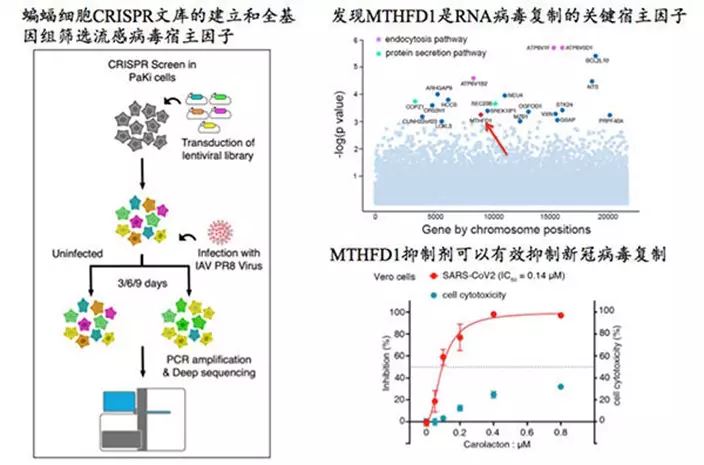
蝙蝠細胞的全基因組CRISPR篩選找到一個RNA病毒復制的關鍵宿主因子MTHFD1,其抑制劑carolacton能有效抑制新冠病毒在靈長類動物細胞系中的復制。
據悉,研究團隊後續將在動物感染模型上進一步對carolacton及其衍生物的抗病毒功能進行臨床前測試,希望能將其作為一種廣譜抗病毒藥物早日推向臨床。MTHFD1相關的基因對病毒的影響及其藥物靶向的研究也有望提供更多的候選藥物分子。
另外,研究團隊前期建立的全基因組篩選系統也將在針對蝙蝠的其它組織細胞,特別是免疫細胞的研究中發揮巨大作用,幫助研究者繼續探尋蝙蝠的更多的奧秘。


