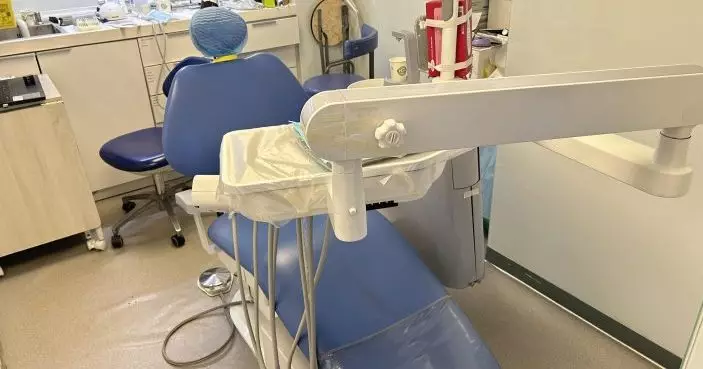
公務員事務局局長聶德權(右三)和食物及衞生局局長陳肇始教授(左三)二月十八日就2019冠狀病毒病疫苗接種計劃舉行記者會。衞生署署長陳漢儀醫生(右二)、醫院管理局行政總裁高拔陞醫生(右一)、政府資訊科技總監林偉喬(左二)及一般職系處長陳信禧(左一)亦有出席。
根據《預防及控制疾病(使用疫苗)規例》(第599K章),新冠疫苗獲認可時,必須訂立機制,以監察任何與使用該疫苗有關並發生在接種者身上的異常事件。
衞生署現行的藥物安全監察系統,一直有接收及分析醫護人員及藥劑業界呈報,有關疫苗接種異常事件的資料,並進行因果關係評估,以確定事件是否與接種疫苗有關。
衞生署亦要求認可疫苗的申請人呈報本地接種疫苗異常事件,並留意其他國家和地區的藥物監管部門及世界衞生組織對有關疫苗的最新安全及成效評估。
另外,衞生署亦夥拍香港大學作主動監測,就接種後可能出現的異常事件,特別是一些值得關注的罕見或嚴重的異常事件(關注事件)(例如: 吉.巴氏綜合症,急性播散性腦脊髓炎等)主動向公私營醫療機構收集數據,並進行因果關係評估, 亦會對特定群組可能出現的常見異常事件進行全面監測。
衞生署已成立新冠疫苗臨床事件評估專家委員會(委員會),就接種新冠疫苗可能出現的臨床事件進行持續監察,並就認可新冠疫苗的安全監察提供專業意見和建議。委員會已制定風險傳達計劃,監察、通報及跟進在疫苗接種計劃進行期間呈報的臨床事件。
跟進行動包括向醫護人員就有關疫苗發出安全警示、更新產品標籖説明書資料、指令疫苗供應商進行藥物回收及建議撤銷疫苗的認可等。
衞生署健康促進處
衞生署
** 博客文章文責自負,不代表本公司立場 **